臨床試験の実施目的は「(1)Ⅱ型糖尿病への有効性検証」、「(2)その他副次的評価項目に係る有効可能性の探索」、及び「(3)安全性の検証」の3 つに大別されます。各目的についてのデータ解析結果概要は以下のとおりでした。
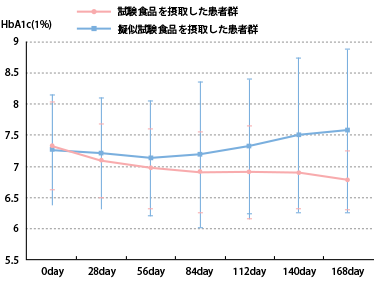
試験における主要評価項目であるHbA1c※1 について、「試験食品飲用群(以下、試験食品群)」単体の経時的変化※2 や「擬似試験食品飲用群(以下、プラセボ群)」との比較優位性検証※3、及び増減人数確認※4 などを分析したところ以下のとおりとなり、Ⅱ型糖尿病への有効性を確認しました。
※1 HbA1c とは、ヘモグロビンに血液中のブドウ糖が結合したもので、糖尿病診断の検査値になっています。国際基準では6.5%以上の場合、糖尿病と診断されます。
※2、※3 有効性評価症例のHbA1c の経時的変化グラフ(平均値±標準偏差)
168day の平均値(6.78±0.47%)は、同群0day の平均値(7.32±0.70%)に対して減少しています。
試験食品群が①のとおり減少しているのに対し、プラセボ群168day の平均値(7.56±1.31%)は、同群0dayの平均値(7.26±0.89%)に対して増加しており、対照的な結果となりました。
※4 有効性評価症例の開始日(0day)を基準とした終了時のHbA1c 増減人数
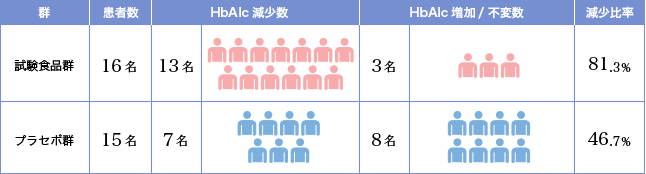
上記のとおり、試験食品群ではHbA1c が168day の段階で減少した人数は13名/16名中で、減少比率は81.3%となりました。一方でプラセボ群の減少人数は7名/15名中で、減少率は46.7%となっています。試験食品群がプラセボ群よりも減少人数/比率共に高く、試験食品がHbA1c 値の降下に作用していることを示唆するものと考えられます。
肝機能指標であるγ-GTP、GOT、GPT について、試験食品群単体の経時的変化やプラセボ群との比較優位性検証、及び増減人数の確認などを通じ、有効性が示唆されていることを確認しました。
全症例の「有害事象」、「併用薬との相互作用」、「合併症に及ぼす影響」について、臨床研究責任医師の診断に基づき確認した結果、試験食品との因果関係は認められず、安全性が高く副作用が無いことを確認しました。
※上記内容はWHO(世界保健機構)のホームページでも公開されています。