臨床試験の実施目的は「アレルギー性疾患への予防/治療有効性検証」、「その他副次的評価項目に係る有効可能性の探索」、及び「副作用のない安全性の検証」の3 つに大別されます。これらのデータ解析結果概要は以下のとおりでした。
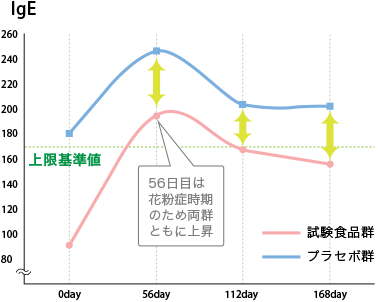
試験における主要評価項目であるIgE※1 について、「試験食品飲用群(以下、試験食品群)」と「擬似試験食品飲用群(以下、プラセボ群)」との比較優位性検証※2 を月毎/visit 毎に分析したところ以下のとおりとなり、IgE の抑制傾向、即ちアレルギー性疾患への有効性を確認しました。
※1 IgE とは、抗体(アレルゲン)に対して反応する免疫グロブリンのことです。
個人差があり明確な基準値はありませんが、一般的には170(IU/ml)が基準値とされます。基準値以上の場合、アレルギー症状が発現しているとされます。
※2 試験食品群とプラセボ群のvisit 毎の中央値経時的変化
試験食品群では56 日目(測定日:3/16~6/7)において季節性アレルギーである花粉症の影響から中央値(195.50IU/ml)が上限基準値170IU /ml を超えたものの、112day では168.00IU/ ml、168day では156.00IU/ml と基準値内に寛解していることから改善傾向が認められます。これに対し、プラセボ群では試験期間中、常に中央値が上限基準値以上であり、比較優位性も認められます。
なお、IgE と同様に主要評価項目としていた「インターロイキン-12」につきましては、有効性評価対象の全患者(33 症例)において検出限界(8pg/ml)未満であったため当該値の変化、及び差異の確認はできませんでした。
肝機能指標であるγ-GTP、GOT について、試験食品群単体の経時的変化やプラセボ群との比較優位性検証、及び増減人数の確認などを通じ、両試験共に有効性が示唆されていることを確認しました。Ⅱ型糖尿病患者向け臨床試験においても同等の結果が出ていることから、肝機能改善性は両試験の共通試験食品であるLB-Scr に拠るところが大きいものと推測されます。
神経系指標であるセロトニンについて、試験食品群単体の経時的変化やプラセボ群との比較優位性検証などを通じ、有効可能性を確認しました。
全症例の「有害事象」、「併用薬との相互作用」、「合併症に及ぼす影響」について、臨床研究責任医師の診断に基づき確認した結果、試験食品との因果関係は認められず、安全性が高く副作用が無いことを確認しました。
※上記内容はWHO(世界保健機構)のホームページでも公開されています。